|
|
CONFIGURATION ÉLECTRONIQUE DES ÉLÉMENTS
LA
CLASSIFICATION PÉRIODIQUE
|
Puisque les nombres quantiques et les règles qui les régissent (règle de HUND, principe d’exclusion de PAULI) demeurent toujours valides, comment peut-on décrire schématiquement l’ensemble des éléments chimiques connus ? Question fondamentale, elle a préoccupé les scientifiques très rapidement alors que la connaissance des éléments s’affinait avec le temps. On devine que si les premières classifications reposaient sur les propriétés physico-chimiques observées, la mécanique quantique est venue apporter d’autres modes de justification.
Objectif : |
Le chapitre précédent nous a donné le moyen de déterminer les orbitales susceptibles de recevoir des électrons. Il nous a montré également qu’on pouvait considérer que tous les atomes possèdent (tout au moins qualitativement) les mêmes orbitales, caractérisées par les nombres quantiques n et l. Quantitativement, les orbitales ne sont pas identiques, comme on peut le voir pour les éléments les plus simples en calculant les fonctions propres y. En d’autres termes, l’énergie de l’orbitale 4s (n = 4, l = 0) de l’atome d’hélium n’est pas égale à l’énergie de l’orbitale 4s de l’atome d’hydrogène (on peut d’ailleurs le voir directement sur le diagramme des niveaux d’énergie - chapitre 7, figure 7.3).
Pour former les divers atomes à partir de leurs éléments, on est amené à remplir les orbitales possibles avec des électrons en augmentant évidemment la charge du noyau. Nous nous intéresserons seulement aux électrons pour le moment.
2. La classification périodique
L’idée de la classification périodique des éléments est apparue dès qu’un nombre suffisant d’éléments eurent été identifiés. À la fin du XVIIIe siècle, on ne connaissait qu’une trentaine d’éléments. Il semble que les premiers essais d’arranger les éléments connus remontent en 1782 avec un nommé Louis Bernard GUYTON DE MORVEAU.
Tableau 8.1. Tableau de substances non décomposables selon GUYTON DE MORVEAU
|
Substances simples |
Substances simples combustibles |
Substances métalliques |
Substances terrestres |
Alcalins |
|
lumière |
N |
As Fe |
SiO2 |
NaOH |
|
Tiré de : Edward G. Mazurs, Graphic Representations of the Periodic System During One Hundred Years, The University of Alabama Press, University, Alabama, 1957, 251+ pages. |
||||
Vers 1820-1830, DÖBEREINER groupa les éléments dont les propriétés étaient similaires par trois et par ordre de poids atomique : les triades. Il remarqua alors que l’élément du milieu avait une masse atomique égale à la moyenne arithmétique faite sur celle des deux autres. Ainsi, le poids atomique du sodium-23, est celui calculé en faisant la moyenne entre celui du lithium-7, et celui du potassium-39.
En 1830, DUMAS propose de regrouper les éléments par famille : celle du chlore, du brome, de l’iode, celle de l’oxygène, du soufre, du sélénium,... Un peu plus tard, NEWLANDS, par analogie avec la gamme musicale, propose un arrangement en octave. Ainsi, la première octave commence avec le lithium, la seconde avec le sodium,... L’hydrogène n’était pas intégré dans ces octaves et il faut se souvenir que les gaz rares étaient alors inconnus. Il y avait donc sept corps simples par octave comme il y a sept notes musicales par octave.
Tableau 8.2. Tableau périodique proposé par MENDÉLÉIEFF en 1869
| I | II | III | IV | V | VI |
|
H = 1 |
Be = 9,4 B = 11 C = 12 N = 14 O = 16 F = 19 Na = 23 |
Mg = 24 Al = 27,4 Si = 28 P = 31 S = 32 Cl = 35,5 K = 39 Ca = 40 |
Ti = 48 V = 51 Cr = 52 Mn = 55 Fe = 56 Ni = Co = 59 Cu = 63,4 Zn = 65,2 ? = 68 ? = 72 As = 75 Se = 78 Br = 80 Rb = 85 Sr = 87 |
Zr = 90 Nb = 94 Mo = 96 Rh = 104,4 Ru = 104,4 Pd = 106,6 Ag = 108 Cd = 112 Ur = 116 Sn = 118 Sb = 122 Te = 128 ? I = 127 Cs = 133 Ba = 137 |
? = 180 Ta = 182 W = 184 Pt = 198 Ir = 198 Os = 199 Hg = 200 Au = 199 Bi = 210 Tl = 204 Pb = 207 |
L’idée de périodicité prend son aspect quantitatif (et perd son aspect poétique ou musical) avec LOTHAR MEYER. En 1864, ce dernier eut l’idée de calculer le rapport du poids atomique à la densité pour chaque élément. En fonction du poids atomique il obtint une courbe en forme de dents de scie similaire à celle apparaissant à la figure 8.4 (voir plus loin). Il observa aussi que sur cette courbe les éléments de propriétés semblables se retrouvent aux mêmes endroits dans la périodicité observée.
L’idée moderne du tableau périodique apparaît définitivement en 1869. À ce moment, on connaissait 63 éléments. Le mérite de MENDÉLÉIEFF est de les avoir organisés en posant sur une même ligne et par ordre croissant de poids atomique les éléments aux propriétés semblables. Il s'est aussi basé sur des propriétés à cette époque mesurables. Tout particulièrement, il s'est fondé sur la similitude des formes cristallines et la faculté qui en dépend de former des mélanges isomorphes. Son tableau contenait les alcalins sur une ligne et dans l’ordre Li, Na, K, Rb, Cs. Une autre ligne contenait les halogènes, une autre les éléments O, S, Se et Te... (Tableau 8.2). Ce tableau n’était pas parfait. Pour respecter les prémisses, le tableau présente des anomalies. Il y a d’abord des cases inoccupées. MENDÉLÉIEFF propose qu’il doit exister des corps simples encore inconnus pour occuper ces espaces vides. Il propose l’éka-aluminium, l’éka-bore, l’éka-silicium. Il est intéressant de comparer les prédictions de MENDÉLÉIEFF relatives aux propriétés de l’éka-silicium - élément 32 - à celles du germanium découvert en 1886 par C. WINKLER (Tableau 8.3).
Tableau 8.3. Comparaisons entre les propriétés de
l’éka-silicium et celles du germanium
| Élément | Éka-silicium | Germanium |
| Poids atomique Densité Couleur Oxyde Chlorure T. d’ébullition |
70 5,5 gris poussière EkO2 EkCl4 < 100 °C |
72,6 5,47 gris blanc GeO2 GeCl4 86 °C |
On remarque aussi que l’antimoine et l’étain sont inversés, par rapport à leur position réelle et que le tellure et l’iode, bien placés, sont inversés par rapport à leur poids atomique. On note aussi que, sans le vouloir, la notion d’éléments de transition fait son apparition.
Lorsqu’en 1895 RAMSAY découvre l’argon et l’hélium, la classification de MENDÉLÉIEFF est brutalement remise en cause puisque aucune place n’est réservée à ces deux gaz rares. RAMSAY proposa alors d’ajouter une nouvelle colonne pour le groupe zéro et il fut amené à prévoir trois autres éléments qu’il allait bientôt isoler: le néon, le krypton et le xénon.
3. Le remplissage des orbitales électroniques
Les principes devraient avoir une base mathématique rigoureuse. Malheureusement, les calculs deviennent beaucoup plus compliqués lorsque le nombre des électrons augmente, et là encore, on généralise quelques règles obtenues pour les éléments simples.
a) Règle de l’énergie minimum
Un état d’équilibre stable correspond toujours au minimum de l’énergie potentielle. Les électrons se placeront sur les orbitales de façon à rendre l’énergie totale minimum. Il est donc nécessaire de classer les orbitales par ordre d’énergie croissante. On sait déjà que l’énergie croît lorsque la valeur du nombre quantique principal n augmente. On peut, de plus, énoncer la règle suivante : de tous les niveaux énergétiques correspondant à un même nombre quantique principal n, le plus profond (c’est-à-dire celui qui possède l’énergie minimum) est ns, les autres s’étageant ensuite suivant les valeurs croissantes de l.
|
|
Figure 8.1. Positions relatives des niveaux d’énergie des orbitales atomiques.
Une telle disposition peut amener un chevauchement des niveaux énergétiques correspondant aux différentes valeurs de n et l . On voit par exemple sur le diagramme (Fig. 8.1) que le niveau 4s est plus profond que le niveau 3d. En conséquence, le niveau 4f se remplit seulement lorsque les couches 5s, 5p, 6s sont complètes et lorsque la couche 5d possède 1 électron (terres rares).
Le nombre quantique magnétique m définit pour chaque valeur de l, 2 l + 1 orbitales possibles (chacune avec sa fonction propre y calculable dans le cas de l’atome d’hydrogène). Nous verrons que, en l’absence d’action extérieure, ces 2l + 1 orbitales ont toutes la même énergie (elles sont dégénérées). Elles comptent cependant dans le nombre des orbitales possibles.
b) Principe d’exclusion de PAULI (1900-1958)
Ce principe est purement empirique, il n’a aucune base en mécanique quantique, il justifie seulement les résultats expérimentaux et la classification périodique.
Chaque orbitale définie par n, l et m ne peut recevoir que deux électrons dont les spins sont antiparallèles.
En d’autres termes, le spin de chaque électron ne peut prendre que les deux positions possibles par rapport au moment cinétique total l de l’orbitale (voir chapitre précédent). On peut encore énoncer ce principe de la façon suivante : un électron seulement possède une série de valeurs des nombres quantiques n, l, m, s qui déterminent les orbitales possibles. Ces orbitales sont résumées dans le tableau ci-dessous. La configuration électronique d’un élément est une notation symbolique résumant la distribution de ses électrons.
Exemples :
Azote 1 s2 2 s2 2 p3
Calcium 1 s2 2 s2 2 p6 3 s2 3 p6 4 s2
c) Règle de HUND
Dans le cas où une sous-couche est incomplète, les électrons se disposent de manière à réaliser le maximum d’états à spins parallèles (voir plus loin l’exemple de l’azote).
Tableau 8.4. Orbitales possibles pour un électron
| Couches | K | L | M | |||||||||||
| n | 1 | 2 | 3 | |||||||||||
| l
|
0 s |
0 s |
1 p |
0 s |
1 p |
2 d |
||||||||
| m s = ± 1/2 |
0 ↓↑ |
0 ↓↑ |
-1 |
0 ↓↑ |
+1 ↓↑ |
0 ↓↑ |
-1 ↓↑ |
0 ↓↑ |
+1 ↓↑ |
-2 ↓↑ |
-1 ↓↑ |
0 ↓↑ |
+1 ↓↑ |
+2 ↓↑ |
| sous-couches | K | L1 | L2 | M1 | M2 | M3 | ||||||||
| nombre de e- | 2 | 2 | 6 | 2 | 6 | 10 | ||||||||
Note : 0 < l < n - 1 et - l < m < + l.
4. Principes guidant l’arrangement des moments cinétiques orbitaux et de spin
L’état de l’atome n’est pas défini lorsqu’on a précisé la position des électrons sur les diverses orbitales. Nous avons vu que l’énergie dépendait également du moment cinétique total. Il est donc essentiel de pouvoir préciser les positions respectives des moments orbitaux et des spins des divers électrons de l’atome. Nous avons vu que ce travail pouvait être fait à partir des données spectroscopiques et que chaque niveau d’énergie pouvait être caractérisé par un symbole (2P3/2, par exemple) qui résume nos connaissances des moments cinétiques. En particulier, pour l’état fondamental de l’atome (niveau d’énergie le plus bas), ce symbole prend le nom de terme fondamental.
Deux cas sont à envisager:
a) Les sous-couches sont complètes :
Les moments orbitaux individuels des électrons s’arrangent pour donner un moment orbital total nul. Les spins individuels s’arrangent également pour donner un spin total nul. L’état fondamental est donc 1S0 . Le nuage électronique ne tourne pas. Il n’y a donc pas d’axe de symétrie autour duquel il y aurait nécessairement rotation du nuage. On dit que l’atome a la symétrie sphérique. C’est le cas des gaz rares par exemple, qui doivent leur grande inertie chimique à cette symétrie sphérique associée au fait que les couches sont complètes. On tire de ce principe le résultat suivant : dans chaque sous-couche, les moments orbitaux et les spins individuels des électrons s’arrangent de manière à ce que le moment cinétique total soit nul.
b) Les sous-couches sont incomplètes :
Dans ce cas, les électrons se disposent de manière à réaliser le nombre maximum d’états à spins parallèles (règle de HUND). Notons en passant que ce fait est justiciable d’une démonstration mathématique rigoureuse. Dans le cas de l’azote, par exemple, les sous-couches 1s et 2s sont complètes, et chaque paire d’électrons sont associés de façon antiparallèle. Mais la couche 2p est incomplète et possède seulement trois électrons pour 3 orbitales possibles. Ces trois électrons vont donc occuper trois orbitales différentes et leur spin seront tous parallèles, ce qui donnera un spin total 3/2. Il en est de même pour l’oxygène par exemple.
Notons tout de suite l’importance de cette règle en ce qui concerne la valence des éléments. La liaison chimique du type atomique est formée par une association d’électrons appartenant aux deux éléments intéressés, cette association se faisant à spins antiparallèles. Il faut pour cela qu’il y ait dans l’élément des spins libres. Si la configuration de gauche était la bonne, l’azote atomique serait monovalent et l’oxygène atomique aurait des propriétés différentes de celles que nous lui connaissons. Par contre, la configuration de droite rend bien compte des valences respectives 3 et 2.
Les moments cinétiques orbitaux se composent de la façon habituelle. Il n’y a pas de règle précise pour déterminer la valeur de la résultante. Dans le cas de l’atome d’azote, pour la couche 2p,
| au lieu de | on a : | |||||
| m | -1 | 0 | +1 | -1 | 0 | +1 |
| s | ↓↑ | ↑ | ↑ | ↑ | ↑ |
Dans le cas de l’atome d’oxygène, pour la couche 2p,
| au lieu de | on a : | |||||
| m | -1 | 0 | +1 | -1 | 0 | +1 |
| s | ↓↑ | ↓↑ | ↓↑ | ↑ | ↑ |
igure 8.2. Organisation électronique des atomes d’azote et d’oxygène.
5. Le tableau périodique des éléments
Les principes précédents permettent, ainsi que nous allons le voir, de rendre compte des périodicités constatées dans le tableau des éléments classés par ordre des numéros atomiques.
Première ligne - du lithium au néon : de Li (3) à Ne (10) :
La progression dans cette ligne correspond à la saturation progressive des niveaux électroniques n = 2 (couche L). La saturation complète correspond au néon.
Seconde ligne - du sodium à l'argon : de Na (11) à A (18) :
Non seulement la couche K (n = 1) est complète, mais aussi la couche L (n = 2). Le remplissage progressif des niveaux 3s, 3p s’effectuant parallèlement à celui de 2s, 2p pour la ligne précédente. Il apparaît ainsi une correspondance deux à deux des éléments de ces deux lignes, qui se reflète dans leurs analogies chimiques. Ainsi se trouve mis en évidence le fait que ce sont les électrons de la dernière couche qui sont pratiquement seuls responsables du comportement chimique de l’élément, d’où leur appellation d’électrons de valence.
Troisième ligne - du potassium au nickel : de K (19) à Ni (28) :
Cette ligne se caractérise par le fait que la couche 4s se sature avant la couche 3d en accord avec le principe du minimum d’énergie. L’énergie de liaison des électrons 4s demeure faible par suite de l’effet d’écran des autres électrons et de leur grande distance au noyau. Ces éléments sont des métaux dits métaux de transition dont le comportement chimique est profondément influencé par la présence d’une couche 3d incomplète.
Tableau 8.5. Configurations électroniques : termes fondamentaux et potentiel d’ionisation des éléments
| Élément | Z | K | L | Terme fondamental | P.I. (eV) | |
| 1s | 1s | 2s | ||||
H |
1 |
1 |
|
|
2S1/2 |
13,595 |
| Élément* | Z | M | Terme fondamental | P.I. (eV) | ||
| 3s | 3p | 3d | ||||
Na |
11 |
1 |
|
|
2S1/2 |
5,14 |
* Structure de l’atome de néon
| Élément | Z | M | Terme fondamental | P.I. (eV) | ||
| 3s | 3p | 3d | ||||
K |
19 |
Structure de l’argon (18) |
|
1 |
2S1/2 |
4,34 |
| Élément | Z | N | Terme fondamental | P.I. (eV) | ||
| 4s | 4p | |||||
Zn |
30 |
Structure du Cu+ (28) |
2 |
|
1S0 |
9,39 |
| Élément | Z | N | Terme fondamental | P.I. (eV) | ||
| 4d | 4f | |||||
Rb |
37 |
Structure du krypton+ (36) |
|
1 |
2S1/2 |
4,18 |
| Élément | Z | O | Terme fondamental | P.I. (eV) | ||
| 5s | 5p | |||||
Ag |
47 |
atome de palladium (46) |
1 |
|
2S1/2 |
7,57 |
Quatrième ligne - du cuivre au krypton : de Cu (29) à Kr (36) :
La couche 3d étant complète, le remplissage des couches 4s, 4p s’effectue progressivement et l’on retrouve la correspondance avec les éléments des deux premières lignes.
Cette description du tableau 8.5 peut être poursuivie ligne par ligne, en utilisant les mêmes principes. Le point le plus remarquable que l’on rencontre alors est le retard à l’occupation de la couche 4f sur laquelle les électrons ne viennent se disposer qu’après saturation de 6s. C’est l’un des succès de la théorie de BOHR de retrouver exactement le nombre des terres rares, de Ce (58) à Lu (71) comme correspondant aux 14 états possibles 4f. La faible participation de ces électrons aux propriétés chimiques montre la grande importance du nombre quantique n en ce qui concerne le rayon moyen de l’orbitale (ou distance moyenne de l’électron au noyau) et explique que les électrons 4f puissent être considérés comme "enterrés" au sein des couches de nombre quantique plus élevé.
Ce tableau 8.5 indique que chaque élément isolé a sa "formule électronique". Ainsi, la formule électronique du silicium s’écrit : 1s2, 2s2 2p6, 3s2 3p2 ou encore sous une forme réduite, en utilisant la structure du gaz rare qui le précède : (Ne, 3s2 3p2). Les mêmes formules pour le molybdène deviennent :
Mo : 1s2, 2s2 2p6, 3s2 3p6 3d10, 4s2 4p6 4d5, 5s1 ou encore (Kr, 4d5, 5s1).
6. Quelques exemples de tableaux périodiques
Depuis NEWLANDS, DÖOBEREIMER, … MENDÉLÉIEFF et bien d’autres auparavant plusieurs dizaines de tableaux périodiques ont été proposés. On trouvera beaucoup de renseignements historiques doublés d’une discussion scientifique de la valeur de plus d’une centaine de propositions dans le livre cité en fin de chapitre. Plusieurs grands noms de la chimie et de la physique ont apporté leurs propres réflexions et propositions. Citons, outre les noms déjà mentionnés, BOHR (1922-1923), CROOKES (1886-1887), LAVOISIER (1787-1789), NERST (1892-1895), OSWALD (1937-1938), …
Le tableau classique avec lignes et colonnes a subi plusieurs modifications. On a aussi proposé des cercles concentriques, des hélices sur un cylindre, sur un cône, des spirales, en forme de lemniscate, sur des plans perpendiculaires à l’axe principal d’une pyramide à base carrée, des combinaisons de ces éléments… Chacune de ces représentations essaie de reprendre la périodicité des propriétés des éléments. Chacune a aussi ses défauts dont une parfois évidente tient à la complexité de sa lecture. Bien évidemment la couleur apporte sa touche à leur lecture. L’usage de la troisième dimension ajoute certaines qualités et facilités de compréhension. Ces représentations tridimensionnelles ne sont cependant guère pratiques pour leur transport. On illustre quelques-unes de ces propositions dans le diaporama qui accompagne ce texte.
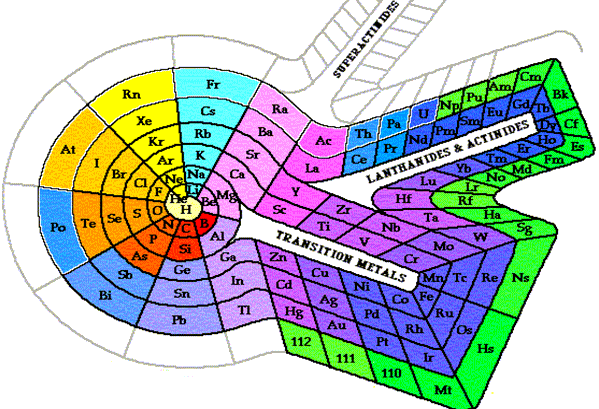 |
8.3. Le tableau périodique de BENFREY
|
Nouvelles périodes |
|
Orbitales |
|||||||||||||
|
1 |
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
1 s |
|
2 |
|
|
|
|
|
|
3 |
4 |
|
|
|
|
|
|
2 s |
|
|
|
|
|
|
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
2 p |
|
3 |
|
|
|
|
|
|
11 |
12 |
|
|
|
|
|
|
3 s |
|
|
|
|
|
|
13 |
14 |
15 |
16 |
!7 |
18 |
|
|
|
|
3 p |
|
4 |
|
|
|
|
|
|
19 |
20 |
|
|
|
|
|
|
4 s |
|
|
|
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
|
3 d |
|
|
|
|
|
|
31 |
32 |
33 |
34 |
35 |
36 |
|
|
|
|
4 p |
|
5 |
|
|
|
|
|
|
37 |
38 |
|
|
|
|
|
|
5 s |
|
|
|
|
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
|
|
4 d |
|
|
|
|
|
|
49 |
50 |
51 |
52 |
53 |
54 |
|
|
|
|
4 p |
|
6 |
|
|
|
|
|
|
55 |
56 |
|
|
|
|
|
|
6 s |
|
|
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
4 f |
|
|
|
|
71 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
|
|
5 d |
|
|
|
|
|
|
81 |
82 |
83 |
84 |
85 |
86 |
|
|
|
|
6 p |
|
7 |
|
|
|
|
|
|
87 |
88 |
|
|
|
|
|
|
7 s |
|
|
89 |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
5 f |
|
|
|
|
103 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
|
|
|
6 d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figure 8.4. Le tableau de
MAZURS.
Note : les éléments de la dernière ligne, élément 104 et plus, ont été connus
après la proposition de MAZURS (1954) ; voir chapitre 16.
7. Potentiels d'ionisation
La valeur du potentiel d’ionisation (pour le premier électron enlevé) renseigne sur l’énergie de liaison de cet électron. Un graphique des potentiels d’ionisation en fonction du numéro atomique est extrêmement instructif. Le fait le plus remarquable est la présence de maxima pour les gaz rares et de minima pour les alcalins. Ceci montre qu’il est facile d’enlever l’électron à l’extérieur d’une couche saturée. La raison est à chercher dans l’effet d’écran créé par les électrons intérieurs. Dans un gaz rare, tel que le néon par exemple, les 8 électrons L sont à peu près à la même distance moyenne du noyau. La charge efficace qui attire l’un de ces électrons est pratiquement 8 e. Par contre, la charge efficace qui attire l’électron du sodium est pratiquement un e par suite de l’effet d’écran.
Les potentiels d’ionisation des autres éléments se trouvent compris entre ceux des gaz rares et ceux des alcalins (Fig. 8.5). On remarque des maxima que l’on peut expliquer :
M(gaz) ® M+ (gaz) + e-(gaz) + DH
|
|
Figure 8.5. Variation du potentiel d’ionisation.
Indépendamment de la méthode déjà décrite à propos des diagrammes de niveaux d’énergie, la mesure du potentiel d’ionisation peut se faire directement. L’expérience de FRANCK-HERTZ (voir Chapitre XII.2) consiste à observer l’apparition des raies dans une atmosphère raréfiée de l’élément considéré bombardé par des électrons dont l’énergie est contrôlée. Au moment où on atteint l’énergie d’ionisation, on voit apparaître les raies caractéristiques de l’ion.
L’élément le plus facile à ioniser est le césium pour lequel atome, le potentiel d’ionisation est de 3,89 eV. Cette valeur n’est cependant pas la plus basse valeur observée. En effet, des potentiels d’ionisation de 3,51 eV ont été mesurés pour des complexes azotés du tungstène : Science, 298, 1971 (2002).
8. Affinité électronique
Alors que les alcalins et les alcalino-terreux abandonnent facilement des électrons pour former des ions positifs, les halogènes et les éléments du groupe de l’oxygène ont une grande tendance à capturer des électrons pour former des ions négatifs. Ils ont une affinité électronique positive, c’est-à-dire que, bien qu’ils soient électriquement neutres, de l’énergie est libérée lorsque les couches les plus extérieures sont remplies par l’adjonction de un ou même deux électrons supplémentaires. La raison de cette affinité électronique positive est la même que celle de l’énergie d’ionisation élevée des halogènes c’est-à-dire l’écran incomplet formé par les électrons de la couche la plus extérieure. Bien que l’atome dans son ensemble soit électriquement neutre, un ou deux électrons additionnels peuvent être maintenus dans la couche extérieure. L’affinité électronique des gaz rares, des alcalins, des alcalino-terreux est zéro, l’électron ne pouvant être maintenu par suite de l’écran, incomplet formé par les électrons des couches intérieures.
L’affinité électronique est égale à l’énergie libérée dans le processus de capture électronique:
M(gaz) + e-(gaz) ® M-(gaz) + DH
La détermination expérimentale directe de l’affinité électronique est difficile bien que des techniques par spectrométrie de masse (ions négatifs) sont assez courantes en ce qui concerne l’affinité électronique des molécules. On utilise, aussi, une méthode indirecte (cycle de BORN-HABER).
Tableau 8.6. Affinité électronique de quelques éléments à 25 °C*
| H 0,75 |
F 3,459 |
Cl 3,61 |
Br 3,36 |
I 3,06 |
| O 1,47 |
S 2,07 |
C 1,25 |
||
* DH298/eV; Barrow, G. M., Physical Chemistry, McGraw-Hill Book Co., (1973). |
||||
|
Les premiers essais de classification sont apparus vers 1830. En 1869. MENDELEIEFF allait proposer les bases modernes du tableau périodique qui porte son nom. Non seulement était-ce un outil de synthèse remarquable, il allait servir de base à la recherche d’éléments alors inconnus. La mécanique quantique vient ensuite identifier complètement la structure de chacun des atomes et confirmer la démarche de la construction du tableau périodique.
|
| 9.1 | Établissez le nombre de protons qui existent dans un noyau de chlore. |
| 9.2 | Combien d’électrons constituent le nuage électronique de l’atome de sélénium ? Indiquez comment se fait le remplissage des couches et sous-couches électroniques. |
Réponse :
1s2 2s2
2p6 3s2 3p6 4s2
3d10 4p4
| 9.3 | L’iode a 53 électrons. Indiquez la répartition de ces électrons dans les couches et sous-couches électroniques en écrivant les formules électroniques. |
| 9.4 | Écrire la formule électronique du titane (Z = 22) et de l’arsénique (Z = 33). |
Réponse :
| 9.5 | En recherchant les valeurs appropriées dans la littérature, vérifiez graphiquement la périodicité des propriétés suivantes : le volume molaire (cm3·mole-1), le rayon atomique, et la masse volumique (g·cm-3). |
| 9.6 | En vous inspirant des indications fournies au tableau 8.5, construisez les sommes vectorielles des moments cinétiques orbitaux, de spin et totaux des atomes de césium, baryum, lanthane et cérium. |
| 9.7 | Même question pour les éléments 68 à 71. |
| 9.8 | Si le remplissage électronique des orbitales se fait dans l’ordre 3s, 3p, 4s, 3d, 4p, qu’elle serait pour les atomes de zinc et de scandium l’écriture (le terme fondamental) représentant l’état fondamental ? |
Pour en savoir plus :
Un rappel historique: Danielle Fauque, 1869 : Dmitri Menfeleïev piblie la « loi périodique des éléments chimiques », L'actualité chimique (France), N° 436, 9-11 (janvier 2019).
Et aussi une excellente description du travail de MENDÉLÉIEFF : Le rôle de l'isomorphisme dans la conception de la loi périodique de Dimitri MENDÉLÉIEFF, L'actualité chimique (France), N° 462, 51-54 (mai 2021).
Un excellent livre sur les nombreuses propositions (peut être une centaine) d'arrangements (de tableaux) périodiques des éléments, malheureusement peut-être introuvable sur le marché (?) :
Edward G. Mazurs, Graphic Representations of the Periodic System During One Hundred Years, The University of Alabama Press, University, Alabama, 1957, 2e Édition 1974,251+ pages, ISBN 0-8173-3200-6.
Bien entendu, le dossier du Tableau périodique des éléments est loin d'être clos. Un article met en exergue une approche basée sur les triades. Il fait aussi un rappel des travaux et propositions récentes. À consulter par les intéressés : E. Scerri, The Role of Triads in the Evolution of the Periodic Table: Past and Present, J. Chem. Educ., 85, 585-589 (2008). Et un autre ouvrage plus récent du même auteur : Le tableau périodique - Son histoire et sa signification, EDP Sciences, 2011, 349 pages.
De nombreuses suggestions de tableau périodique des éléments à travers l'Histoire : https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?Button=3D+Formulations et https://en.wikipedia.org/wiki/Alternative_periodic_tables (visités le 2021-05-10).
Et du professeur Paul-Antoine GIGUÈRE de l'université Laval.
En voici un proposé par la Société chimique de France très riche de nombreuses informations : https://www.lelementarium.fr/
Voir aussi la Fondation Nobel :
PAULI : https://www.nobelprize.org/prizes/physics/1945/pauli/facts/ (visité le 2019-02-19)
Dernière mise à jour : 2021-07-02.
x x x x x x x x x x x x