| [5.1]
[5.2] |
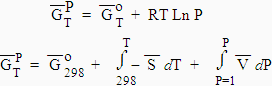 |
(à température constante, voir Chapitre
4.4, équation [4.7])
|
CHAPITRE V
LA THERMODYNAMIQUE DES MÉLANGES
APPLIQUÉE AUX GAZ PARFAITS
|
On vient de voir dans les chapitres précédents les définitions et les propriétés des principales fonctions thermodynamiques. Avant de les appliquer aux systèmes chimiques et aux réactions chimiques, il convient d’en faire l’application aux systèmes physiques simples et en tout premier au plus simple de tous : le gaz idéal. Le cas des mélanges de gaz est particulièrement intéressant. Question : Objectif :
|
1. Rappels de quelques propriétés
1.a L’énergie libre molaire
La fonction énergie libre varie avec la température et la pression :
| [5.1]
[5.2] |
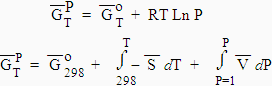 |
(à température constante, voir Chapitre
4.4, équation [4.7])
|
Si la pression P n’est pas la pression de référence, c’est-à-dire la pression atmosphérique, 1 atmosphère,
| [5.3] |
|
1.b L’entropie molaire
La dérivée de la fonction énergie libre par rapport à la température à pression constante est égale à l'opposé de la fonction entropie :
[5.4] |
|
voir le théorème d’EULER [3.10] si Po = 1 atmosphère. |
| Note : |
|
si Po ≠ 1 atmosphère. |
Note :
I-c L’enthalpie molaire
|
[5.5] Þ [5.6] |
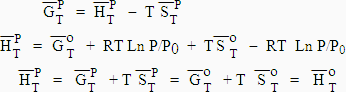 |
La fonction enthalpie est indépendante de la pression.
2. Mélange de gaz parfaits
2.a Loi de DALTON (1766-1844)
Dans un mélange gazeux idéal, la pression partielle d’un constituant est égale à la pression totale du mélange multipliée par la fraction molaire de ce constituant : PA = P yA.
La pression partielle d’un gaz est la pression qu’aurait ce gaz s’il était seul dans le volume considéré. |
Si le mélange est constitué de nA moles de A, nB moles de B, ... et d'un nombre total n de moles, on a la relation :
S ni = n.
La fraction molaire du composé A est yA,
yA = nA/n,
et la somme des fractions molaires est égale à l'unité : S yi = 1.
La pression totale est évidemment égale à la somme des pressions partielles :
[5.7] Þ P = Si Pi (Pression totale = S pressions partielles), ou encore :
Pi = yi P avec Si yi = 1 où yi est la fraction molaire.
[5.8] Pi = ( ni / V )RT si ni est le nombre de moles du composé i :
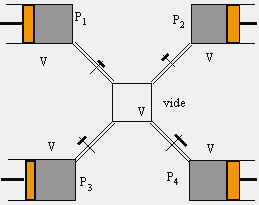
|
|
| État initial | État final |
Figure 5.1. Mélange de gaz avec variation de volume.
2.b Énergie libre par mole de mélange et énergie libre de mélange (mélange isotherme)
Une mole de mélange contient N (AVOGADRO) molécules, chaque gaz contribue pour yiN. Supposons que chaque gaz soit dans des volumes V identiques et séparés. Chacun est ainsi sous une pression Pi (Fig. 5.1, état initial). On transvase ensuite le contenu de chaque volume dans un autre même volume V préalablement vide. Dans ce nouveau volume, chaque gaz conserve sa pression partielle (Fig. 5.1, état final).
P = Si Pi ; Pi V = yi RT PV = RT = S yi RT car ni = 1 et Sni = 1.
Avant le transvasement, l’énergie libre de chaque gaz était :
| [5.9] |
|
Après transvasement, chaque pression individuelle n’a pas variée et comme les gaz sont parfaits il n’y a pas d’interaction entre les molécules semblables ou de type différent. L’énergie libre molaire du mélange est :
| [5.10] |
|
Un mélange de plusieurs gaz initialement chacun dans un volume V identique mais à des pressions initiales différentes Pi dans un volume final, lui aussi de volume V, se fait sans changement d’énergie libre (Fig. 5.1).
|
|
|
| État initial | État final |
Figure 5.2. Mélange de gaz sans variation de volume.
Envisageons maintenant un cas différent. Ici, tous les gaz sont dans des récipients (isolés les uns des autres) de volume différent et à la même pression P et à la même température (Fig. 5.2, état initial). Les volumes sont tels que :
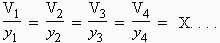
Ouvrons les valves isolant ces volumes : chacun des gaz va naturellement diffuser de son volume initial vers l’ensemble des réacteurs (Fig. 5.2, état final). Chaque gaz se détend de la pression initiale P à la pression partielle finale Pi de telle sorte que P = Si Pi.
| Avant le mélange,
l’énergie libre totale était :
Après le mélange, l’énergie libre totale sera : |
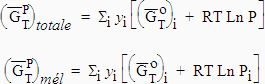 |
|
[5.12] |
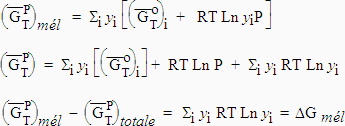 |
Comme yi < 1,0 Þ Ln yi < 0 et la différence précédente est toujours négative. On voit que la variation de l’énergie libre au cours de la transformation est négative. La diffusion d’un gaz dans un autre est un processus spontané qui diminue l’énergie utilisable.
2.c Entropie de mélange
Le théorème d’EULER donne (voir le chapitre III, équation [3.10]) :
| [5.13] |
|
= - Si yi R Ln yi = DSmél |
Comme yi est < 1,0, Ln yi < 0 et la variation d’entropie est positive. Le mélange de gaz est un processus spontané qui se fait naturellement avec augmentation de l’entropie.
2.d Enthalpie de mélange
|
[5.14] Þ |
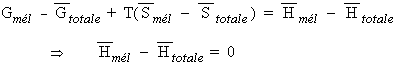
|
Conclusion :
Un mélange de plusieurs gaz initialement dans des volumes différents Vi, mais tous à la même pression P dans un volume totale V = Si Vi résulte en une pression totale P, chaque gaz atteignant une pression partielle Pi, se réalise (Fig. 5.2)
| - sans changement
d’enthalpie (aucun échange de chaleur avec l’extérieur), |
|
| - avec variation
d’énergie libre :
- avec variation d’entropie : |
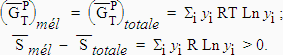 |
L’augmentation de l’entropie se fait au détriment de l’énergie libre.
2.e Interprétation de l’entropie de mélange
![]()
Cette relation traduit le fait que le mélange de composants gazeux est un phénomène irréversible. Considérons la détente d’un gaz 1 d’un volume V1 à un volume V1 + V2.
|
[5.15] |
|
En effet, voir le chapitre III, équation [3.19] :
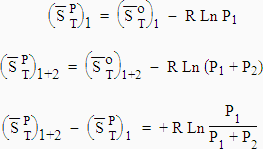
Comme le produit 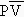 est constant,
est constant,
|
Pour un gaz 2 [5.16] |
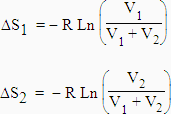 |
C.Q.F.D. |
Considérons le mélange des gaz 1 et 2, chacun étant initialement à la pression P, [5.13],
| [5.17]
[5.18] |
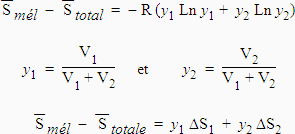 |
Ce résultat s’interprète assez facilement car pour séparer à nouveau les deux gaz dans les volumes respectifs V1 et V2, il ne faut pas plus d’énergie (de travail) que pour comprimer les y1 moles de 1 (pur) dans le volume V1 à partir de V1 + V2 et de même pour le gaz 2 pur.
|
3. Conclusions Les fonctions thermodynamiques s’appliquent simplement aux mélanges de gaz parfaits. Le mélange de plusieurs gaz qui conservent leur pression initiale se fait sans variation d’énergie libre. Le mélange de plusieurs gaz qui diffusent dans l’ensemble des volumes contenant ces gaz se fait :
Ce type de mélange est irréversible.
|
4.1. On veut amener 1 kg de glace qui se trouve à la température de – 10 °C à l’état vapeur à l00 °C. On donne les capacités calorifiques molaires et les chaleurs latentes molaires suivantes :
- glace : 37,6 J/°C/mol ; eau liquide : 75,2 J/°C/mol
- fusion : 6 020 J/mol ; vaporisation : 40 400 J/mol
Calculez l’énergie qu’il faut fournir.
Réponse : Énergie
requise = 1 710,5 kJ.
Dernière mise à jour : 2021-07-08.
x x x x x x x x x x x