| (14.2) |
|
CHAPITRE XIV
MAGNÉTISME ET STRUCTURE MOLÉCULAIRE
|
La symétrie moléculaire a aussi son influence sur le magnétisme de la molécule. La susceptibilité magnétique dépend en particulier du nombre d‘électrons non appariés. Questions : Objectif
:
|
14.1 Rappel des propriétés magnétiques de l’atome
On sait que l’atome peut
présenter deux moments magnétiques d’origines différentes :
• le moment diamagnétique que l’on peut appeler moment de distorsion puisqu’il est en fait une perturbation de nuage électronique créé par le champ extérieur.
• le moment paramagnétique qui résulte d’un moment magnétique propre. Il peut être orienté par le champ extérieur.
Le paramagnétisme a lui-même deux origines selon que le moment magnétique est dû à la rotation des électrons sur leur orbite (moment orbital) ou à la rotation des électrons sur eux-mêmes (moment de spin). Si le nombre quantique orbital total est L, le moment orbital sera L mB (mB est le magnéton de BOHR). Si le nombre quantique de spin total est S, le moment de spin sera 2 S mB puisqu’à un spin 1/2 correspond un moment magnétique égal à un magnéton de BOHR. La somme vectorielle de ces deux moments (s’ils existent simultanément) n’est pas en général un nombre entier de magnétons de Bohr à cause de l’introduction du facteur de LANDÉ (voir cours de physique moderne ou l’équivalent).
Pour qu’un élément soit doué de propriétés paramagnétiques, il est donc nécessaire que le moment magnétique résultant de ses atomes ne soit pas nul (L ou S ¹ O). Si on fait des mesures sur des éléments pris à l’état solide on constate que beaucoup d’entre eux sont diamagnétiques même ceux qui ne sont pas dans l’état fondamental 1S0. L’association des atomes dans les cristaux se fait souvent de façon à annuler les moments magnétiques entre atomes voisins. Le moment propre de l’ensemble est alors nul et le solide est seulement diamagnétique (voir plus loin, paragraphe 14.5).
Tableau 14.1. Quelques valeurs de susceptibilité
Éléments |
État fondamental |
Susceptibilité spécifique |
Li |
2S1/2 |
+0,50 (e- libres) |
Be |
1S0 |
- 1 |
B |
2P1/2 |
- 0,69 |
Na |
2S1/2 |
+0,51 (e- libres) |
Al |
2P1/2 |
+0,65 (e- libres) |
Cu |
2S1/2 |
- 0,086 |
Bi |
2S1/2 |
- 1,35 |
14.2 Moments magnétiques moléculaires
On sait déjà que les orbites électroniques des molécules sont qualitativement de même nature que celle des atomes. Le phénomène de diamagnétisme existera donc également dans les molécules.
Si un atome possède un spin non apparié, on sait qu’il s’accouple de façon antiparallèle avec un autre spin non apparié pour former une molécule. Le moment résultant de spin est donc en général nul. Par exemple, deux atomes d’azote N (4S3/2) forment une molécule N2 (1S).
De plus, les moments orbitaux des atomes s’arrangent le plus souvent pour s’annuler réciproquement dans les molécules. Par exemple un atome de carbone C (3P0) et un atome d’oxygène O (3P2) donnent CO (2S).
En résumé, un grand nombre de molécules sont dans l’état électronique 2S et ne présentent donc pas de moment magnétique propre donc pas de paramagnétisme.
On trouve également des associations exceptionnelles conduisant à des molécules paramagnétiques. En voici deux exemples simples. Deux atomes d’oxygène O (3P2) donnent une molécule O2 (3S). Un atome d’oxygène O (3P2) et un atome d’azote N (4S3/2) conduisent à la molécule NO (2P).
Le paramagnétisme existe cependant de façon normale pour les molécules comprenant des atomes dont les couches intérieures sont incomplètes (cas des éléments de transition). Dans la plupart des cas, les moments orbitaux s’associent pour donner une résultante nulle. Le plus souvent, le paramagnétisme moléculaire provient du moment de spin. La valeur du moment magnétique est donc en général en relation directe avec le nombre d’électrons célibataires de la molécule.
14.3 Susceptibilité magnétique
Il existe une analogie complète de formule entre la valeur du moment électrique d’un dipôle électrique et la valeur du moment magnétique d’un dipôle magnétique. De même les moments magnétiques et les moments électriques par unité de volume sont analogues. La formule donnant le moment magnétique par unité de volume est :
(14.1) I = m0 c H
I = moment magnétique par unité de volume ;
m0 = perméabilité magnétique du vide = 1,256 64 10-6 kg·m·s-2·A-2 = 4p10-7 N·A-2 ;
c = susceptibilité par unité de volume (sans dimension: pas d’unités) ou encore susceptibilité volumique ;
m0 H = champ magnétique efficace = B (l’induction: unité tesla (T)).
On peut pousser plus loin l’analogie en séparant les effets para et diamagnétiques et en introduisant les susceptibilités correspondantes cP et cD
I = (cD + cP) m0 H
Cette formule a son homologue électrique dans :
I = n (ae + an + ao) Eeff.
I = n (aD + ao) Eeff.
Il reste à admettre que le champ magnétique efficace est m0H (c’est-à-dire l’induction B) et que la susceptibilité par unité de volume est l’équivalent de la polarisabilité par unité de volume. cD est l’équivalent de la polarisabilité de distorsion et cP l’équivalent de la polarisabilité d’orientation. Il en est bien effectivement ainsi si on regarde le phénomène à l’échelle moléculaire.
Définissons une susceptibilité magnétique molaire totale:
| (14.2) |
|
Ce coefficient a la dimension de M / r, c’est-à-dire un volume. On a :
![]()
| (14.3) (14.4) |
 |
Le
symbole m
représente le moment magnétique de la substance. Ces résultats sont
applicables sans modifications à la molécule. ![]() sera étendue aux orbites moléculaires et
représentera le moment magnétique moléculaire. cD représente bien un effet de distorsion sur la molécule
alors que cP représente un effet
d’orientation des moments magnétiques
moléculaires permanents.
sera étendue aux orbites moléculaires et
représentera le moment magnétique moléculaire. cD représente bien un effet de distorsion sur la molécule
alors que cP représente un effet
d’orientation des moments magnétiques
moléculaires permanents.
Les calculs sont exactement identiques pour la molécule que l’on peut écrire :
L’analogie entre les effets
électriques et magnétiques s’arrêtent ici puisque
![]() et
et
![]() sont des signes opposés alors que
les termes électriques correspondants (PD et PO) sont
des signes identiques.
sont des signes opposés alors que
les termes électriques correspondants (PD et PO) sont
des signes identiques.
L’effet diamagnétique existe toujours mais est relativement faible. Le problème de l’étude magnétique d’une substance peut donc se poser ainsi :
- la mesure de la susceptibilité totale
- la séparation de l’effet diamagnétique et de l’effet paramagnétique
- la connaissance du moment magnétique propre de la molécule.
Diamagnétisme et paramagnétisme sont tous deux intéressants pour la connaissance de certains aspects de la structure moléculaire.
14.4 Mesure de la susceptibilité magnétique
Un appareil commode pour la mesure de la susceptibilité est la balance magnétique de GOUY, à condition de posséder plusieurs grammes de substance. Un échantillon de matière contenu dans un cylindre de verre de section interne S est suspendu à une balance sensible. Une extrémité du cylindre se trouve entre les pôles d’un aimant capable de produire un champ magnétique intense H1. À l’autre extrémité du cylindre, le champ H2 est souvent négligeable comparé à H1: cas du champ magnétique terrestre. Si la différence de masse apparente avec et sans champ est Dm, la forme agissante sur le spécimen et provenant du gradient de champ est :
F = Dm g
Dans cette égalité, g est l’accélération de la pesanteur. Si la susceptibilité volumique de l’air est c2 et celle de l’échantillon c1 la force exercée sur le barreau peut se calculer (en SI) :
F = 1/2 (c1 - c2) (H12 - H22) S m0
et
![]()
|
|
Figure 14.1. Schéma de la balance de GOUY.
Si H2 est négligeable vis-à-vis de H1 et si de plus c2 est petit devant c1, alors
| Donc: |  |
À partir de la susceptibilité volumique, on peut calculer la susceptibilité molaire en multipliant par le poids moléculaire et en divisant par la densité. La mesure de la dimension de l’échantillon et de la force du champ peut être évitée si l’appareil est calibré avec un corps de susceptibilité connue (solution de chlorure de nickel par exemple).
Des méthodes en courant alternatif ont été développées. Elles permettent d’avoir une sensibilité bien meilleure, c’est-à-dire de pouvoir travailler sur des échantillons très petits. Elles sont toutes basées sur la variation du coefficient de self-induction d’une bobine dans laquelle on déplace l’échantillon. L’échantillon et la bobine sont placés dans le champ magnétique; l’échantillon est animé d’un mouvement périodique sinusoïdal autour de sa position d’équilibre; la bobine fournit un signal électrique à la même fréquence dont la grandeur dépend de la variation de self, donc du moment magnétique de l’échantillon.
 |
Champ magnétique dans le vide : |
 |
Effet d’une substance diamagnétique sur
les lignes de champ : les lignes de champ sont repoussées par la substance |
 |
Effet d’une substance paramagnétique sur
les lignes de champ : les lignes de champ sont attirées par la substance |
Figure 14.2. Effet du champ magnétique sur une substance.
14.5 Diamagnétisme
La mesure de la susceptibilité diamagnétique est aisée lorsque ce phénomène existe seul. La plupart des substances organiques répondent à cette condition. On a constaté de plus, que la susceptibilité diamagnétique est une grandeur approximativement additive. Cette propriété est due au fait que la susceptibilité dépend du nombre et du rayon des orbites électroniques. Ces quantités sont assez peu modifiées lorsque les atomes s’associent pour former des molécules. On peut donc considérer la susceptibilité diamagnétique d’une molécule comme la somme approximative des susceptibilités des atomes constituants. Par recoupement entre les diverses molécules organiques, on peut attribuer à chaque atome un nombre c qui chiffre sa contribution au diamagnétisme total. Ce nombre n’a évidemment aucun lien avec les propriétés magnétiques propres de l’atome. Puisque la nature de la liaison intervient pour modifier la géométrie des orbitales, on est obligé d’introduire des corrections de constitution ou incréments l pour tenir compte de la correction à apporter. La susceptibilité diamagnétique d’une molécule comportant n atomes peut donc être approximativement calculée par la formule :
|
(14.6) |
|
Les constantes ci et lj sont appelées aussi les constantes de PASCAL. Les tableaux 14.2 et 14.3 montrent quelques données numériques tirées de la littérature.
Tableau 14.2. Susceptibilités diamagnétiques molaires par atomes ou groupe d’atomes
Atomes |
ci (106 cm3) |
Atomes |
ci (106 cm3) |
H |
- 2,85 |
O alcool, éther |
- 4,61 |
C |
- 6,00 |
O aldéhyde, cétone |
+1,66 |
N chaîne ouverte |
- 5,55 |
O ester |
- 3,36 |
N anneau |
- 4,61 |
F |
-11,5 |
N monoacide |
- 1,54 |
Cl |
- 20,10 |
N diamide, imide |
- 2,11 |
Br |
- 30,6 |
Si |
- 13 |
I |
- 44,6 |
P |
- 10 |
S |
- 15 |
As |
- 21 |
Se |
- 23 |
Tableau 14.3. Incréments de liaison pour la susceptibilité diamagnétique
Liaisons |
Incrément |
Liaisons |
Incrément |
C = C |
+ 5,47 |
N = N |
+ 1,85 |
C = C¾C = C |
+ 10,6 |
pyridine |
+ 0,50 |
¾C º C¾ |
+ 0,77 |
cyclohexane |
- 3,0 |
anneau saturé C3 |
+ 3,40 |
anneau saturé C4 |
+ 1,10 |
benzène |
- 1,5 |
C dans un anneau aromatique |
- 0,24 |
C dans deux anneaux aromatiques |
- 3,1 |
C dans trois anneaux aromatiques |
- 4,0 |
etc. |
|
||
lj (106 cm3/mol) |
|||
Cette méthode, bien qu’approchée est utile, d’une part pour déterminer ou confirmer la nature de l’édifice moléculaire et surtout, d’autre part, pour évaluer la correction de diamagnétisme dans les substances paramagnétiques.
D’autres applications aux
études de structure peuvent être faites. En voici un exemple: dans les cristaux on
trouve souvent que la susceptibilité est anisotropique et la détermination des
susceptibilités principales peut être utilisée pour obtenir des informations sur la
structure du cristal. La méthode est principalement restreinte aux molécules aromatiques
plates. Dans les molécules de cette sorte les valeurs de ![]() sont largement perturbées par
l’effet de délocalisation des
électrons. Certains électrons (électrons p) ne sont plus localisés autour de
l’atome de carbone mais
occupent une orbitale moléculaire qui entoure la totalité de la molécule. Dans ces
conditions n’est plus de l’ordre de grandeur du rayon atomique mais de l’ordre de grandeur
du rayon moléculaire.
sont largement perturbées par
l’effet de délocalisation des
électrons. Certains électrons (électrons p) ne sont plus localisés autour de
l’atome de carbone mais
occupent une orbitale moléculaire qui entoure la totalité de la molécule. Dans ces
conditions n’est plus de l’ordre de grandeur du rayon atomique mais de l’ordre de grandeur
du rayon moléculaire.
Dans ces conditions, la susceptibilité magnétique doit avoir une valeur normale mesurée dans le plan de l’anneau, et une valeur beaucoup plus grande mesurée dans le plan perpendiculaire à l’anneau. Dans le naphtalène, par exemple, les deux susceptibilités molaires principales sont dans le plan de l’anneau - 53,9 10-6 et - 56,1 10-6 cm3 alors que la susceptibilité perpendiculaire au plan de l’anneau a la valeur - 169 10-6 cm3. Dans le cas du graphite, molécule géante, la susceptibilité dans les plans moléculaires est - 5 10-6 cm3 alors que la susceptibilité perpendiculaire à ces plans est - 275 10-6 cm3. En inversant l’argumentation précédente on peut déduire l’orientation des plans moléculaires de la direction du maximum de susceptibilité.
Un point curieux doit être noté. Les susceptibilité mesurées dans plusieurs directions, dans le plan de la molécule d’hexaméthylbenzène ne sont pas tout à fait égales. Il en est de même de tous les dérivés du benzène complètement substitués. Aucune explication de ce défaut de symétrie magnétique n’a pu encore être donnée.
14.6 Paramagnétisme
On pourrait déduire le moment magnétique propre de la molécule à partir de l’équation 14.5 en utilisant une méthode de variation de température analogue à celle employée pour le moment dipolaire: voir Chapitre 13.6. On préfère ne pas appliquer cette méthode et simplement calculer la susceptibilité paramagnétique en faisant la différence entre la susceptibilité totale mesurée et la susceptibilité diamagnétique calculée à partir de la loi additive. En général, le résultat obtenu est satisfaisant car, de toute façon, on ne peut pas tirer la valeur exacte de m dans la plupart des cas pour la raison suivante.
L’équation 14.5 montre que la susceptibilité paramagnétique varie comme l’inverse de la température. Cette relation est démontrée par le calcul de LANGEVIN pour des molécules isolées, c’est-à-dire lorsqu’on peut négliger les effets d’interaction entre les moments magnétiques. Dans la plupart des solides ou des liquides on ne peut négliger cette interaction et on montre que ces corps obéissent à la loi de CURIE-WEISS, c0 = c/(T-q) c’est-à-dire que la susceptibilité est inversement proportionnelle à T - q, q étant une constante seulement dans un domaine restreint de température. q est rarement connu et, dans la plupart des cas, on admet que la substance obéit à la loi de CURIE. On obtient donc un moment magnétique qui n’est pas le moment réel mais que l’on peut appeler moment effectif. Cette valeur est suffisante pour la plupart des applications mais on ne s’étonnera pas que la concordance de cette valeur avec la valeur prédite par la théorie ne soit en général pas très bonne.
Le paramagnétisme, à quelques exceptions près est généralement associé au nombre d’électrons non appariés. L’absence de paramagnétisme peut être un guide précieux pour la formulation correcte d’un composé. Par exemple, tous les sels connus de l’acide hypophosphorique H2PO3 sont diamagnétiques; la formule correcte n’est donc pas H2PO3 (41 électrons) mais H4P2O6 avec tous les électrons appariés. Pour la même raison, le chlorure mercureux doit être écrit Hg2Cl2.
Considérons une molécule possédant n électrons célibataires le spin total est donc :
S = n/2
La valeur du moment cinétique de spin en unité h/2p est donc :
![]() .
.
Chaque unité h/2p de moment cinétique de spin contribue pour deux magnétons de BOHR au moment magnétique total. La valeur du moment magnétique mesurée en magnétons de BOHR sera donc :
 |
|
1 magnéton de BOHR en SI = mB = 9,273 2 10-24 A · m2
ou encore, en CGS : mB = 9,273 2 10-21 erg · Gauss-1 .
On peut donc obtenir le tableau théorique (tableau 14.4) qui relie le moment magnétique de la molécule mesuré en magnétons de BOHR et le nombre d’électrons célibataires.
Tableau 14.4. Moment magnétique et électrons célibataires
Nombre d’électrons célibataires |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
S |
1/2 |
1 |
3/2 |
2 |
5/2 |
6/2 |
7/2 |
m (en magnétons de BOHR) |
1,73 |
2,83 |
3,87 |
4,90 |
5,92 |
6,93 |
7,94 |
Susceptibilité magnétique |
1 260 |
3 360 |
6 290 |
10 100 |
14 700 |
20 120 |
26 410 |
La comparaison entre ces valeurs théoriques et les valeurs mesurées, bien que pas toujours très concordantes, peut apporter des informations sur le nombre d’électrons célibataires et, par là sur la nature des liaisons dans une molécule. Par exemple, pour la molécule d’oxygène, on mesure une valeur de cm = 3 360 × 10-6. Cette technique est utilisée actuellement très largement pour décider de la structure des complexes métalliques (Tableau 14.5).
Tableau 14.5. Susceptibilités magnétiques molaires à la température ordinaire
|
Substances diamagnétiques |
cm × 106 |
Substances paramagnétiques |
cm × 106 |
|
Sb (s) C (s) CaCl2 (s) Br2 (l) H2O (l) CCl4 (l) CO2 (g) H2S (g) NH3 (g) C2H2 (g) |
- 99,0 - 6,0 - 54,7 - 56,4 - 13,0 - 66,6 - 21,0 - 25,5 - 18,0 - 12,5 |
Al (s) Mg (s) CuCl2 (s) TiCl3 (s) UCl3 (s) O2 (g) NiCl2 (s) CoSO4 (s) FeSO4 (s) FeCl2 (s) |
16,5 13,5 1 180 1 110 3 460 3 449 6 145 10 000 10 200 14 750 |
|
Valeurs en cm3/mol (CGS). Valeurs tirées de Maron, S. H. & C. F. Prutton, Principles of Physical Chemistry, 4e éd., The MacMillan Co, New York (1965). |
|||
14.7 Exemples de détermination des structures à l’aide des propriétés paramagnétiques - magnétochimie
a. Le cas des ions Fe++ et Fe+++
La mesure de la susceptibilité permet de faire la distinction entre les ions ferriques Fe+++ et les ions ferreux. Les règles de répartition des électrons sur les divers niveaux possibles conduisent aux schémas électroniques suivants :

Dans Fe+++ , le nombre d’électrons célibataires est de 5 : il provoque la formation d'un moment magnétique égale à 5,9 mB. Dans le Fe++, il est de 4 et le moment magnétique est de 4,9 mB.
Le moment magnétique effectif mesuré devrait être voisin de 5,92 mB dans le cas de l’ion ferrique et seulement 4,9 mB dans le cas de l’ion ferreux. Les deux valeurs sont suffisamment éloignées l’une de l’autre pour l’imprécision sur la mesure du moment effectif et cela n’empêche pas de prendre une décision.
Le même raisonnement pour les ions cuivriques et cuivreux est utilisable. L’ion cuivreux est diamagnétique avec tous les électrons appariés, et l’ion cuivrique est paramagnétique avec un électron célibataire.
Un grand nombre de discussions sont centrées sur le type de liaison dans certains complexes métalliques. Dans K3[FeF6] on observe un moment de 6,0 mB alors que dans K3[Fe(CN)6] le moment est seulement 2,3. L’ion K+ n’intervient pas car il a la structure électronique d’un gaz rare. Les deux corps sont formés par un ion complexe octaédrique dont l’indice de coordination est 6. La différence est attribuée à la différence de nature des liaisons entre le fer et les atomes ou molécules coordonnées. Dans le premier cas la liaison est ionique et dans le second elle est atomique (covalente) avec mise en commun des paires d’électrons selon les schémas ci-dessous :
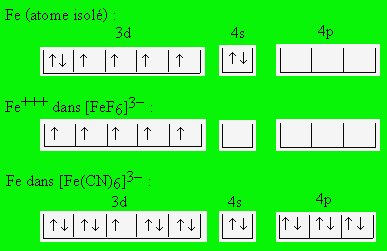
À l'atome de Fe isolé, il correspond un moment magnétique de 4,9 mB, à celui de Fe+++ dans [FeF6]3-dont le nombre d’électrons célibataires est de 5, un moment magnétique de 5,9 mB et à celui de Fe+++ dans [Fe(CN)6]3- un moment magnétique de 1,7 mB correspondant à un 1 électron célibataire. L'hybridation d2sp3 qui résulte de cet assemblage électronique conduit à la formation d'orbitales octaédriques.
Autrement dit, dans le premier cas il existe un ion Fe+++ libre par suite de la capture des électrons par les atomes très électronégatifs F. Dans le deuxième cas, il y a échange de l’électron libre des groupements CN-.
Les valeurs 1,7 et 2,3 mB ne sont pas très concordantes, mais le résultat est cependant suffisant pour pouvoir choisir sans ambiguïté entre les deux types de structures possibles.
Le cas du fer pentacarbonyle Fe(CO)5 est différent. L’atome de fer isolé requiert 10 électrons pour compléter sa structure électronique pour atteindre celle du gaz rare supérieur, le krypton. On peut représenter l’addition du doublet libre de chacune des cinq molécules d’oxyde de carbone comme devant compléter une orbitale 3d, l’orbitale 4s et les trois orbitales 4p : l’hybridation obtenue est de type dsp3. La structure du fer pentacarbonyle est de type trigonal bipyramide. Comme tous les électrons sont appariés cette molécule n’a pas de moments magnétique.
Fe dans Fe(CO)5 :

Cas du fer ferreux hexahydraté :
L’ion ferreux Fe++ forme aussi des complexes de coordination. La structure de l’ion apparaissant plus haut montre qu’il a besoin de douze électrons pour compléter les orbitales 3d, 4s et 4p et ainsi la structure électronique du gaz rare. La molécule d’eau contient au moins un doublet libre sur son atome d’oxygène. L’ion ferreux s’entoure de six molécules d’eau et l’hybridation d2sp3 qui en résulte prend à nouveau la structure octaédrique : 4 molécules forment un plan carré au centre duquel se trouve l’ion ferreux et les deux autres molécules d’eau sont situées de part et d’autre de ce carré sur l’axe perpendiculaire passant au centre de ce carré. On obtient une structure (une hybridation) similaire à celle du complexe à ceci près que maintenant tous les électrons sont appariés et que la molécule de fer hexahydraté n’a pas de moments magnétique.
Fe dans Fe(H2O)6 :
| 3d |
4s |
4p |
||||||||
| ¯ | ¯ | ¯ | ¯ | ¯ |
¯ |
¯ | ¯ | ¯ | ||
| orbitales octaédriques : hybridation d2sp3 | ||||||||||
Le nombre d’électrons célibataires : 0, moment magnétique : 0 mB.
b. Le cas des complexes du nickel
Les différences de propriétés magnétiques ont été utilisées pour montrer que l’arrangement autour de l’atome de nickel dans Ni(NH3)4, Ni(N2H4)2SO4 est tétraédrique, alors que dans des corps tel que K2Ni (CN)4 l’arrangement est coplanaire. Cette différence de structure est due à la différence dans la qualité (s, p ou d) des orbitales mises en commun.

L'atome de Ni isolé ainsi que celui chargé deux fois positivement ont chacun deux électrons célibataires donnant lieu ainsi à la présence d'un moment magnétique. Dans le cas du complexe [Ni(NH3)4]++ la structure conduit à une hybridation de type sp3, donc tétraédrique. Le nombre d'électrons célibataires est encore de 2 : la valeur du moment magnétique observé doit être similaire à celle mesurée pour l'ion nickel Ni++ ou à celle de l'atome isolé.
Ni (dans [Ni(NH3)4]++) :

Dans le cas du complexe [Ni(CN)4]-- la situation est différente puisque le complexe conduit à une hybridation dsp2 dans laquelle tous les électrons sont appariés : le moment magnétique est nul.

c. Autre exemple
Fe2(CO)9 contient deux atomes de fer qui devraient normalement être paramagnétiques. En effet, chaque groupe cède une paire d’électrons au fer, selon le schéma ci-dessous. Le groupe CO central donne un électron à chacun des deux atomes de fer :
|
|
Figure 14.3. Structure possible de la molécule de fer nonacarbonyle.
Chacun des atomes de fer hérite donc de neuf électrons suivant le schéma électronique ci-après. Dans cette hypothèse le matériau devrait donc être paramagnétique puisque chacun des atomes de fer posséderait un électron célibataire. En réalité, il est diamagnétique. Il y a donc mise en commun d’une paire d’électrons entre les deux atomes de fer. Ces deux atomes doivent donc être beaucoup plus rapprochés que ne l’indique le schéma ci-dessus.
Fe+++ (dans [Fe2(CO)9 :

Ce fait est confirmé par l’analyse aux rayons X. La structure correcte doit donc être :
|
|
Figure 14.4. Structure de la molécule de fer nonacarbonyle.
On connaît bien sûr de nombreux autres complexes de coordination. Citons des composés dicoordinés : Cu(C2O4)22-, AgCl2-, tricoordinés : Zn(OH)3-, tétracoordinés : Cu(NH3)4++, Cu(CN)42- , Zn(OH)42-, ZnCl42-, Hg(NCS)42-, ... hexacoordinés : Fe(SCN)63-, etc., etc.
|
On distingue deux
sortes de susceptibilité : la susceptibilité diamagnétique et la susceptibilité
paramagnétique. La première est générale et constitue une propriété additive du nombre
d’atomes avec corrections pour la nature de certaines liaisons. La seconde
n’apparaît qu’en présence d’électrons non appariés. |
1. La susceptibilité magnétique molaire de l’oxygène moléculaire à 25 oC est 3449,0 10-6 cm3. En négligeant la susceptibilité diamagnétique, calculez le moment magnétique de cette molécule en CGS, en SI.
Réponse : m = 2,66 10-20 unités CGS = 26,60 10-24 A·m2.
2. La susceptibilité magnétique molaire du sulfate, X2(SO4)3, est de 7,24 10-2 cm3 à 20 ºC. En négligeant la susceptibilité diamagnétique, calculez :
-1 le nombre quantique de spin électronique,
-2 le nombre d’électrons non appariés dans la molécule, dans chaque ion X3+, et
-3 le moment magnétique de X2(SO4)3 en magnétons de Bohr.Réponse : m = 13 mB.
3. En utilisant la table des susceptibilités diamagnétiques, calculez la susceptibilité magnétique du benzène.
4. Le K3[Mn(CN)6] a un moment magnétique molaire voisin de 3 magnétons de Bohr. En admettant la structure électronique suivante pour l'atome de manganèse isolé, proposez la structure électronique du manganèse dans le complexe [Mn(CN)6]3- :
Mn (atome isolé) :
Pour en savoir un peu plus
Liens intéressants :
Sur le Web :
Un site en provenance du département de chimie de l’University of West Indies, Kingston 7, Jamaïque, prof. Dr. Robert Lancashire, propose la mesure d’un moment magnétique à l’aide de la balance de GOUY : http://wwwchem.uwimona.edu.jm/lab_manuals/gouytheory.html (site visité le 2019-02-26)
À nouveau voir le magnétisme dans l'index sous "Curie temperature" le site http://hyperphysics.phy-astr.gsu.edu/hbase/hframe.html (visité le 2019-02-26)..
Dernière mise à jour : 2021-07-07.
___________________________________